醫藥網2月25日訊 罕見病雖小���,卻是一門大生意��?���!段也皇撬幧瘛匪幬镌透窳行l���,最初就是以“孤兒藥”獲批�,最后成為年銷售峰值逼近50億美元的超級“重磅炸彈”���。在世界罕見病日(2月28日)即將到來之際��,中美兩國政府針對“罕見病”藥物提出不同舉措�����。
中國:加快審批上市+減稅
2月11日�����,國務院總理李克強主持召開國務院常務會議時指出��,要保障2000多萬罕見病患者用藥�����。為鼓勵罕見病制藥產業發展�,降低患者用藥成本���,2月20日�,財政部��、海關總署�����、稅務總局�����、藥監局四個部門聯合發文����,明確了罕見病藥品增值稅政策�。
即從3月1日起����,對首批21個罕見病藥品和4個原料藥(波生坦����、吡非尼酮����、青霉胺���、利魯唑)�����,參照抗癌藥對進口環節減按3%征收增值稅��,國內環節可選擇按3%簡易辦法計征增值稅�����。在此之前��,這些藥物的增值銳為16%(見:官方發布首批降稅罕見病藥品清單?。?��。
降稅罕見病藥品清單(第一批)
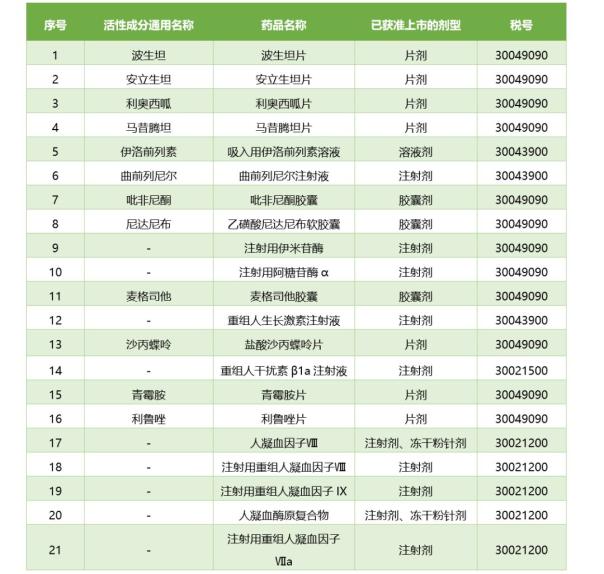
早在2018年5月21日��,國家衛生健康委員會等五部門聯合制定了《第一批罕見病目錄》���,首次以官方名義公布了121種罕見性疾病�。在這121個病種中��,而這些病種多數處于無藥可治的狀態����,且只有約20種在國內獲得批準���。(見:官方罕見病目錄背后的中國孤兒藥開發現狀)���。
更早之前�����,國家藥品監督管理局(原CFDA)出臺了鼓勵創新36條��,明確表示對于罕見病藥物注冊審批實行優先審評��,特別提出對境外已批準上市的罕見病治療藥品醫療器械��,可附帶條件批準上市��,確認試驗數據可以后續提供���。在政策的加持下�,罕見病藥物也正以前所未有的速度在中國推出���。例如�,羅氏血友病A藥物Hemlibra僅在美國FDA批準一年后(2018年11月)獲得批準�����。
FDA:加強安全評估+擴大同情用藥范圍
無獨有偶��,FDA近日也更新了《罕見病用藥開發指南》(Rare Diseases:Common Issues in Drug DevelopmentGuidance for Industry)�����,這是繼2015年后首次在安全性評估���、自然病史研究和患者參與等方面有重大改進���。
在提到安全性的部分時�,指南指出�����,“可行和充分的安全評估是屬科學監管范疇��, 既基于每種藥物和不同的疾病類型帶來的特殊挑戰��, 也包括患者對風險的容忍度和未滿足的醫療需求的程度����。”
FDA列舉了數種加強安全評估的方法��。比如:考慮特定疾病患者的特殊挑戰��,最大限度地擴大上市前安全數據的收集�。收集可靠的自然病史數據���,以便區分與藥品相關的不良反應和潛在疾病的關系�����。指南特別強調�,藥品開發商要嚴格收集和分析數據�����。
指南還指出�,臨床試驗的患者招募和排除標準應該不必要過多限制患者獲得臨床好處的資格���。 只要倫理和實踐上可行�����, 藥企應使用同時比較的手臂設計 (例如�, 安慰劑����, 不治療�, 護理標準�, 活性藥物���, 多劑量)�,以便對不良事件的因果關系做更好的解釋��。
比如設計一個與有效性試驗平行運行的安全隊列的試驗設計協議��,安全隊列包括的患者人群是那些研究人員認為可能受益于正在臨床試驗的新藥物�����, 但患者本人又不符合臨床試驗入組標準的人�。另一個安全隊列的患者人群���,可以是那些接受同情用藥的患者�,即患有重大或危及生命的疾病的患者獲得未經FDA批準的研究性新藥��。
"開發治療罕見疾病的新藥面臨諸多挑戰����。比如患者人數少導致臨床試驗招募進展緩慢��;患者本身也很難發現更多藥企�����,找到多種不同藥品��。尤其是對患友罕見疾病的重癥患者����,存在遠未被滿足的治療需求���。" FDA局長Scott Gottlieb博士在一份聲明中說���。“ 擴大同情用藥�����,不僅有利于藥品開發企業的臨床數據收集�,也利于那些生命垂危又無法通過傳統途徑獲得在研新藥的患�����。”